Тема: Альдегиды.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ -
органические вещества, содержащие карбонильную группу
АЛЬДЕГИДЫ
| |||
ОБЩАЯ ФОРМУЛА:
RCOH или СnH2nO
| |||
Предельные
CnH2n+1-CН=О
|
Непредельные
CH2=CH-CН=О
акролеин
|
Ароматические
С6H5-CН=О
бензальдегид
| |
Суффикс - АЛЬ
| |||
Изомерия альдегидов:
Номенклатура альдегидов и кетонов
Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода.
Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
|
Формула
|
Название
|
|
|
систематическое
|
тривиальное
|
|
|
H2C=O
|
метаналь
|
муравьиный альдегид (формальдегид)
|
|
CH3CH=O
|
этаналь
|
уксусный альдегид (ацетальдегид)
|
|
CH3CH2CH=O
|
пропаналь
|
пропиновый альдегид
|
|
CH3CH2CH2CH=O
|
бутаналь
|
масляный альдегид
|
|
(CH3)2CHCH=O
|
2-метил-пропаналь
|
изомасляный альдегид
|
|
CH3CH2CH2CH2CH=O
|
пентаналь
|
валериановый альдегид
|
|
CH3CH=CHCH=O
|
бутен-2-аль
|
кротоновый альдегид
|
Физические свойства альдегидов
Метаналь (формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов:
Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
Ацетальдегид – жидкость , с запахом зелёной листвы. ОЧЕНЬ ТОКСИЧЕН! Подавляет дыхательные процессы в клетках.
Акролеин СН2 = CHCH=O акриловый альдегид, пропеналь (в производстве полимеров) – образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C6H5CH=O (производство красителей) – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
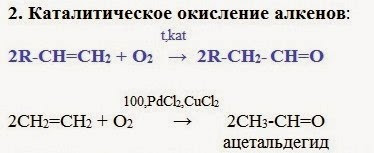
Получение альдегидов
I. В промышленности
Этот способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
В промышлености альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr
или Zn).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
II. В лаборатории
1. Гидратация алкинов (раньше использовали в промышленности – способ дорогой) - присоединение:
Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
2. Окисление спиртов:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
При окислении вторичных спиртов образуются кетоны.
Химические свойства альдегидов
Для карбонильных соединений характерны реакции различных типов:
· присоединение по карбонильной группе;
· полимеризация;
· конденсация;
· восстановление и окисление.
I. Реакции присоединения
1. Присоединение водорода (восстановление):
R-CH=O + H2 t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной):
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
R-CH(CN)OH + H2O -> R-CH(COOH)OH + NH3
CH3-CH=O + H-CN → CH3-CH(CN)-OH
CH3-CH(CN)-OH циангидрин –яд! в ядрах косточек вишен, слив
3. Присоединение воды:
II. Реакции окисления
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
2. Окисление гидроксидом меди(II):
3. Альдегиды могут быть окислены до кислот бромной водой
III. Реакции замещения
С галогенами:
CH3-CH=O + Cl2 → ClCH2-CH=O + HCl здесь , ClCH2-CH=O - хлоруксусный альдегид
n CH2=O t,kat → ( -CH2-O-)n полиформальдегид
n H-CH=O + (n+1) C6H5-OH t,kat→ nH2O + [-C6H3(OH)-CH2-C6H3(OH)-]n фенолформальдегидная смола
Применение
Метаналь (муравьиный альдегид) CH2=O
- получение фенолформальдегидных смол;
- получение мочевино-формальдегидных (карбамидных) смол;
- полиоксиметиленовые полимеры;
- синтез лекарственных средств (уротропин);
- дезинфицирующее средство;
- консервант биологических препаратов (благодаря способности свертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О
- производство уксусной кислоты;
- органический синтез.

















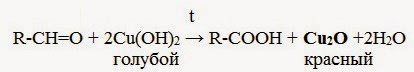


Комментариев нет:
Отправить комментарий