Строение электронных оболочек атомов
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
Рис. 1. Бор Нильс Хендрих Давид (1885–1962)
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
Виды электронных орбиталей
|
Форма орбитали в пространстве
|
Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
| |||||||
s – орбиталь
(электронное облако s – электрона)
|
сфера (шар)
|
Электронное облако такой формы может занимать в атоме одно положение
(условное обозначение)
| |||||||
p – орбиталь
(электронное облако p – электрона)
|
гантель (восьмёрка)
|
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(условное обозначение)
| |||||||
d – орбиталь
(электронное облако d – электрона)
|
четырёхлепестковая форма
|
Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре.
А пятая - вроде гантели, продетой в бублик
(условное обозначение)
| |||||||
f – орбиталь
(электронное облако f – электрона)
|
сложная форма
|
Электронное облако такой формы может занимать в атоме семь положений.
(условное обозначение)
|
Условное обозначение электрона – стрелка, направленная вверх↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз↓ (электрон вращается вокруг собственной оси против часовой стрелки).
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
↑↓
|
Cледовательно, на s – орбитали максимально может разместиться два электрона (s2); на p – орбитали максимально может разместиться шесть электронов (p6) на d – орбитали максимально может разместиться десять электронов (d10); f – четырнадцать электронов (f14).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Условное обозначение уровня - скобка: )
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
Порядок заполнения уровней и подуровней электронами.
I. Электронные формулы атомов химических элементов составляют в следующем порядке:
· Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
· Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
· Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
· Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
1. у элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
2. у элементов побочных подгрупп на внешнем уровне обычно дваэлектрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне нольэлектронов);
3. число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
I. Порядок заполнения электронами атомных орбиталей определяется:
1.Принципом наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
2. Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
III. Формулы отражающие строение атомов первого и второго периодов
H +1 )1e
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s1
– электронная формула, отображает число электронов по орбиталям.
+1 Н
↑
|
- электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
ЗАКРЕПЛЕНИЕ
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
а) +30 б) +31 в) +15 г) +5
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента; б) номеру группы;
в) заряду ядра атома; г) номеру периода
3. Число нейтронов в атоме цинка равно
а) 30 б) 35 в) 4 г) 2
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
а) убывают; б) возрастают; в) не изменяются; г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
а) Li б) Br в) C г) N
6. Электронная формула строения атома меди, это-
а) 1s22s22p63s23p64s23d10; б) 1s22s22p63s23p64s23d9;
в) 1s22s22p63s23p64s13d10 ; г) 1s22s22p63s23p64s13d11 .
7. Заряд ядра атома кальция равен
а) 20 б) 2 в) 40 г) 41
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
а) номеру периода; б) номеру группы; в) порядковому номеру элемента; г) атомной массе.
9. Число нейтронов в атоме железа равно
а) 26 б) 55 в) 56 г) 30
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
а) уменьшается; б) не изменяется; в) увеличивается; г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
а) RH4; б) RH3; в) RH2; г) RH.
12. Электронная формула строения атома мышьяка, это-
а) 1s22s22p63s23p64s13d114p3; б) 1s22s22p63s23p64s23d94p4;
в) 1s22s22p63s23p64s13d104p4 ; г) 1s22s22p63s23p64s23d104p3 .





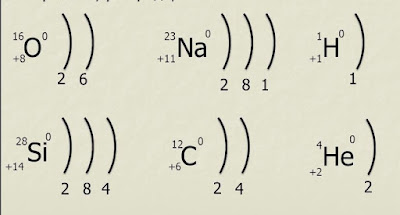



Комментариев нет:
Отправить комментарий